Nessun risultato di contenuto corrisponde alla tua parola chiave.
Contenuto
Sei uscito con successo.
Non sei ancora registrato?
Regolamenti sui dispositivi medici
Il nuovo Regolamento europeo sui dispositivi medici (MDR) con molte nuove regole rappresenta una sfida per tutti i soggetti coinvolti. B. Braun si sta preparando intensamente e desidera applicare i nuovi requisiti il prima possibile. Qui abbiamo raccolto per voi alcune informazioni sull'MDR.
Cliccando "Confirm" dichiari di essere un operatore sanitario.
Se sei un paziente o un giornalista visita le pagine a te dedicate.
Conferma Sì, sono un operatore sanitario. Cancella No, non sono un operatore sanitario.Il nuovo Regolamento europeo sui dispositivi medici (MDR) è entrato in vigore a maggio 2017. Il nuovo regolamento sostituisce la Direttiva sui dispositivi medici (MDD) e la Direttiva sui dispositivi medici impiantabili attivi (AIMDD).
Circa 500.000 dispositivi medici in Europa saranno ricertificati in conformità alla nuova politica sostanzialmente più completa per ricevere il marchio CE. Secondo le stime attuali, circa il 65% dei dispositivi medici sarà certificato secondo il nuovo regolamento. Alcuni organismi notificati sono ancora in fase di designazione e non è completamente chiaro quanti organismi notificati saranno in grado di concludere il processo (elenco sul sito web della Commissione europea ). A causa dell'aumento dei requisiti imposti agli organismi notificati e ai produttori, sono previsti e inevitabili adeguamenti del portafoglio.
I prodotti devono avere un'applicazione MDR firmata (ad eccezione dei prodotti MDD che stanno per esaurirsi)
/
Certificato MDD "Periodo di tolleranza": Nessuna modifica di progettazione per i prodotti certificati MDD
/
I certificati MDD mantengono la validità (la tempistica dipende dalla classe di rischio del prodotto)
/
Tra le altre cose, queste aree sono interessate:
Al fine di garantire una fornitura continua con tecnologie mediche sicure e innovative, tutti i produttori si trovano ad affrontare il difficile compito di superare i crescenti requisiti necessari per ricevere il marchio CE. Gli enti notificati devono gettare le fondamenta e creare una capacità sufficiente per la procedura di valutazione della conformità.
Da tempo B. Braun ha iniziato a implementare la certificazione dei propri dispositivi medici in conformità all'MDR. Naturalmente, questo vale per tutti i prodotti che B. Braun produce e acquista come prodotti commerciali per completare il proprio portfolio. In relazione all'avanzamento delle misure adottate, B. Braun è sicura di poter soddisfare i requisiti dell'MDR fino a maggio 2024.
È stata resa necessaria a livello europeo una revisione della direttiva sui dispositivi medici 93/42 CEE (DDM), resa pubblica nel 1993 e ancora oggi in vigore. Con il nuovo regolamento, le autorità UE vorrebbero migliorare la qualità dei dispositivi medici e aumentare la sicurezza, armonizzare i processi in tutta l'UE e aumentare la sicurezza del paziente. Ulteriori aspetti includono il miglioramento della trasparenza e della tracciabilità in relazione alle nuove tecnologie che consentono una chiara identificazione di tutti i prodotti per l'intero ciclo di vita.
L'MDR definisce i requisiti che un produttore deve soddisfare per vendere dispositivi medici in Europa. Sono interessati sia i requisiti tecnici di un prodotto che quelli relativi al monitoraggio dei prodotti utilizzati nelle strutture sanitarie.
Vi sono diversi cambiamenti che riguardano la classificazione dei prodotti. Oltre all'introduzione della nuova classe lr per gli strumenti chirurgici riutilizzabili, i requisiti posti ai prodotti impiantabili di classe IIb sono stati particolarmente elevati. Inoltre, numerose categorie di prodotti sono state assegnate a una classe di rischio più elevata. L'MDR aumenta i requisiti relativi alle prove cliniche dei dispositivi medici. In futuro, tutti i dispositivi medici, indipendentemente dalla loro classe di rischio, richiederanno una valutazione clinica. La procedura di controllo recentemente introdotta prevede un migliore monitoraggio dei nuovi prodotti impiantabili di classe di rischio III, nonché dei dispositivi medici attivi che somministrano e/o rimuovono medicinali di classe IIb prima del lancio sul mercato. Oltre all'aumento dei requisiti imposti ai produttori, gli enti notificati sono soggetti a norme più severe. Per poter approvare i dispositivi medici, devono essere soddisfatti diversi requisiti aggiuntivi. Inoltre, gli enti notificati sono tenuti a eseguire audit non annunciati presso i produttori. I requisiti aggiuntivi sulla documentazione tecnica che devono essere forniti dai produttori stanno aumentando notevolmente la portata e la complessità della documentazione.
Non è presente un identificativo esatto che indichi la conformità MDR. Tuttavia, oltre all'introduzione dell'MDR, sull'etichetta verrà apposto un nuovo simbolo ISO "MD" per i dispositivi medici.
Sì, sono interessati tutti i dispositivi medici di tutte le classi di rischio, comprese le unità e i sistemi di trattamento.
I dati rilevanti per il pubblico sono resi accessibili in una banca dati europea centrale già esistente. La versione ampliata di EUDAMED sarà introdotta gradualmente, ovvero uso volontario di una versione "minimal viable product" (MVP). L'uso obbligatorio dell'EUDAMED è previsto in accordo alla linea temporale EUDAMED.
I fabbricanti di dispositivi medici, sistemi e kit procedurali, gli importatori o i rappresentanti autorizzati per la distribuzione di dispositivi medici nell'UE, devono aggiungere i dati in EUDAMED relativi al ruolo dell'attore, nonché i dati rilevanti per ogni singolo prodotto da distribuire nell'UE.
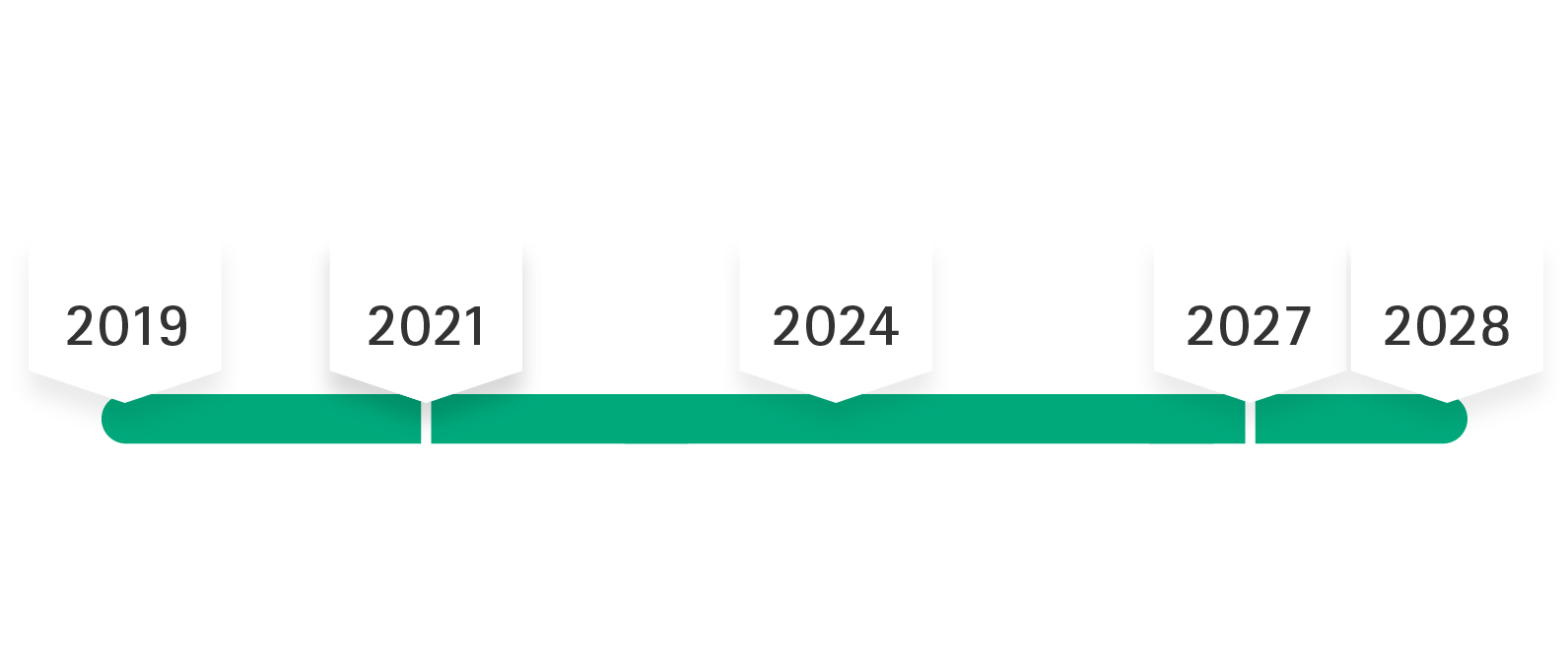
Dopo la pubblicazione dell'MDR, avvenuta il 5 maggio 2017, il regolamento è entrato in vigore il 26 maggio 2017, con un periodo di transizione che si prevedeva durasse fino al 26 maggio 2020. A causa della pandemia da COVID-19, l'applicazione obbligatoria dell'MDR è stata posticipata a maggio 2021. In base al secondo emendamento dell'MDR, il tempo di transizione viene esteso fino al massimo dicembre 2028, ovvero i certificati MDD manterranno la loro validità (per esempio Dicembre 2027 per i prodotti delle classi di rischio IIb impiantabili e III), se sono soddisfatti determinati requisiti.
I dispositivi medici non devono presentare rischi inaccettabili per la salute e la sicurezza.
Il QMS deve essere già conforme all'MDR.
L'applicazione MDR è firmata entro maggio 2024.
Il contratto MDR con l'Organismo notificato sarà firmato entro settembre 2024.
non è necessario apportare modifiche significative ai prodotti MDD.
In accordo al secondo emendamento dell'MDR, non esiste più alcun periodo di sell-off definitivo. Il periodo di vendite massicce pianificato in precedenza è stato cancellato (per esempio è stata annullata la distribuzione di prodotti certificati MDD entro maggio 2025).
Estensione automatica della validità del certificato CE MDD (nessun nuovo certificato da emettere).
I certificati CE MDD e MDR saranno validi in parallelo per tutto il periodo di estensione della timeline.
Sia i prodotti MDD che quelli MDR possono essere immessi sul mercato in parallelo.
A causa della pandemia da COVID-19, l'applicazione obbligatoria per l'MDR è stata fissata per il 26 maggio 2021. Ciò comporta i seguenti termini per la commercializzazione di dispositivi medici in base alle classi di prodotto:
Classe I: 26 maggio 2021
Classe Ir, s, m, Classe IIa, Classe IIb e Classe III: 26 maggio 2024
La valutazione di conformità indica se un prodotto e il rispettivo produttore sono conformi ai requisiti europei MDR. A seconda della classificazione dei rischi dei singoli prodotti, B. Braun ha il diritto di eseguire autonomamente questo audit. Le valutazioni aggiuntive vengono eseguite da un cosiddetto "organismo notificato".
Un organismo notificato è una società privata nominata per conto dell'Unione europea per valutare la conformità di un produttore all'MDR. Attualmente sono in fase di valutazione con audit e, una volta superati gli audit, gli enti notificati valuteranno i processi dei produttori di dispositivi medici per la conformità MDR. Non appena la conformità dei processi viene verificata, i prodotti trattati possono essere registrati attraverso questi processi.
Anche dopo la conversione dell'intera gamma di prodotti all'MDR, le aziende manifatturiere si troveranno ad affrontare costi aggiuntivi significativi a causa dell'aumento dei requisiti dell'MDR.
Gli obiettivi principali del regolamento sono una migliore protezione della salute pubblica e della sicurezza dei pazienti, più trasparenza, sicurezza legale e un concetto più orientato all'Europa. Questo obiettivo deve essere raggiunto attraverso una documentazione tecnica più approfondita sui prodotti interessati in un sistema di gestione della qualità conforme all'MDR.
In qualità di produttore di dispositivi medici, B. Braun deve rispettare i requisiti dell'MDR. Diversi gruppi di lavoro stanno aggiornando la documentazione tecnica e rivedendo i processi per garantire la conformità MDR. Inoltre, B. Braun è tenuta a fornire informazioni sul prodotto, inclusi dati univoci di identificazione del dispositivo (UDI), nonché informazioni di sorveglianza post-commercializzazione all'EUDAMED.
Il Gruppo B. Braun ha avviato misure complete e fornito risorse per garantire l'implementazione puntuale dell'MDR.
Tutti i dispositivi medici.
B. Braun si sta preparando intensamente per le nuove normative e presume che sarà in grado di rispettare la tempistica.
I sistemi di gestione della qualità di B. Braun sono già stati certificati ai sensi del MDR. Il trasferimento dei prodotti all'MDR avverrà in successione entro la scadenza massima prevista.
In linea generale, sì - a seconda del ciclo di vita pianificato, i prodotti sono certificati secondo MDR. Come negli anni precedenti, B. Braun continuerà ad apportare modifiche alla propria gamma di prodotti. I nuovi prodotti saranno aggiunti al portafoglio e le vecchie generazioni saranno sostituite, oppure i prodotti non profittevoli o obsoleti saranno rimossi dal portfolio prodotti. Nell'ambito del nostro regolare processo di gestione dell'assortimento, continueremo a comunicare i cambi di assortimento dei prodotti corrispondenti in modo tempestivo, aperto, trasparente e mirato ai rispettivi clienti interessati e, se possibile, offriremo loro delle alternative.
Durante il periodo di implementazione di MDR, B. Braun presenterà sul mercato sia i prodotti certificati MDD che MDR.
TÜV Süd è stato riconosciuto come secondo ente notificato a livello mondiale nel maggio 2019. Altri organismi notificati che supervisionano i dispositivi medici di B. Braun sono MedCert, Dekra e TÜV Rheinland, che hanno ricevuto la loro designazione anche ai sensi dell'MDR. Per avere una panoramica degli organismi notificati accreditati MDR, consulta il link al sito web della Commissione europea.
Sito web della Commissione europea
a) L'identificazione di un dispositivo medico cambierà attraverso l'inclusione dell'identificazione univoca del dispositivo (UDI).
b) È possibile che siano previsti ulteriori obblighi di documentazione per i nuovi prodotti di Classe III.
c) Il database EUDAMED offre ai clienti una maggiore trasparenza in merito ai prodotti.
B. Braun è già pronta per MDR e ha già fatto investimenti di diversi milioni di euro per raggiungere questo obiettivo. I principali fattori di costo sono i requisiti più completi per la documentazione tecnica, le soluzioni tecniche e sistemiche per soddisfare la gestione dei dati EUDAMED richiesta e i maggiori sforzi di sorveglianza post-vendita.
B. Braun supporta attivamente i clienti nell'ottenimento di informazioni. A tal fine, le dichiarazioni di conformità e le informazioni per l'uso (IFU) sono messe a disposizione in modo digitale consecutivamente da maggio 2021.
Le dichiarazioni di conformità sono disponibili online all'indirizzo www.bbraun.com - basta inserire il nome del prodotto nel campo di ricerca e trovare la Dichiarazione di conformità corrispondente sotto l'intestazione - documenti correlati-. La maggior parte delle dichiarazioni di conformità di B. Braun Melsungen AG e B. Braun Avitum AG sono accessibili tramite questo canale. Per motivi tecnici, B. Braun potrà mettere a disposizione online le dichiarazioni di conformità per i prodotti Aesculap AG (ad eccezione della gamma di materiali di sutura) solo a medio termine. Per la fornitura casuale di dichiarazioni di conformità, che non possono essere reperite online, è possibile contattare il servizio clienti della filiale nazionale B. Braun.
Le istruzioni per l'uso possono essere scaricate all'indirizzo https://eifu.bbraun.com Dopo aver inserito il codice articolo o il GTIN, vengono visualizzati i documenti relativi al prodotto.
Ecco una raccolta di link utili a informazioni sui siti web ufficiali della Commissione europea e su altre fonti.
Scheda informativa per i professionisti sanitari (sito web dell'UE)
link
EU-Giornale: Regolamenti sui dispositivi medici
link
Elenco degli organismi notificati (UE)
link
Cronologia EUDAMED (UE)
link
B. Braun Istruzioni per l'uso elettroniche (eIFU)
link
Scheda informativa B. Braun sull'MDR
pdf, 53.6 KB
Domande e risposte sugli aspetti pratici delle disposizioni di transizione all'MDR
link